骨缺损是由创伤、感染、肿瘤切除或关节翻修等多种因素引起的骨连续性破坏和结构完整性丧失,临床上自体骨移植因具有良好的生物相容性,被视为“金标准”,但供区有限且并发症发生率较高[1];异体骨移植虽然在一定程度上缓解了骨源不足的问题,但存在免疫排斥和疾病传播的潜在风险[ 2 ]。近年来,3D 打印多孔钛支架(3D-printedporoustitaniumscaffold,3DP-PTS)凭借可控的孔隙结构、优良的力学性能以及良好的生物相容性,成为当前研究的热点方向[3-4]。研究表明,合理优化孔径和孔隙率可模拟松质骨特性,也可以促进细胞黏附和骨组织长入;同时,表面功能化修饰及生物活性分子负载有助于提升骨整合能力,并赋予材料抗感染和促血管生成等功能[5-6]。目前,部分个体化3DP-PTS 已用于髋臼、下颌骨及长骨缺损的重建,并取得初步效果。然而,3DP-PTS 的临床转化仍面临长期生物安全性、制造精度和成本效益等挑战。本文将综述 3DP-PTS 在孔隙结构设计、表面修饰和活性分子负载等方面的研究进展,结合临床应用现 状,探讨其优势与局限,并展望智能涂层、免疫调控及人工智能辅助设计等前沿方向,以期为骨缺损修复提供新的思路和参考。
1、3DP-PTS 的孔隙设计与骨再生效能关联性
3DP-PTS 的孔径、孔隙率及连通性直接影响骨长入效率与力学稳定性,通过模拟天然的人骨单位结构,理想的多孔钛支架孔隙率为 60%~90%,孔径为 300~900μm[7]。临床前研究表明,孔径 300~600μm 可兼顾细胞浸润与机械支撑,当孔径<200μm 时,限制了细胞渗透和迁移,导致细胞主要停留在支架表面,难以形成深入的细胞-基质相互作用;而孔径>800μm 虽可以促进血管化,但抗压强度显著降低,难以满足承重骨需求[8];在孔隙率方面,3DP-PTS 相较于钽、不锈钢等金属材料,弹性模量接近松质骨,可减少应力屏蔽引发的继发性骨吸收[9-10]。鲁斌[11] 在兔股骨髁骨缺损模型中对比不同孔隙率支架,发现 3D 打印的不同孔径支架(900、1 200、1 500μm)均能实现骨组织长入。在合适的范围内较大孔径有利于早期骨及骨髓样组织的快速长入;而较小孔径则更利于后期骨组织的大量形成。针对结构连通性不足的问题,邓威等[12] 的动物实验显示,多孔钛材料具有良好的成骨性能和骨传导性,其连通的多孔结构不仅利于成骨细胞长入和分化,还利于血管生成和营养物质交换,从而促进新生骨的形成与成熟。研究表明,孔径决定细胞迁移阈值,孔隙率主导力学衰减曲线,适宜的孔隙结构可促进与周围骨组织形成稳定固定,加速骨骼系统的重建[13]。
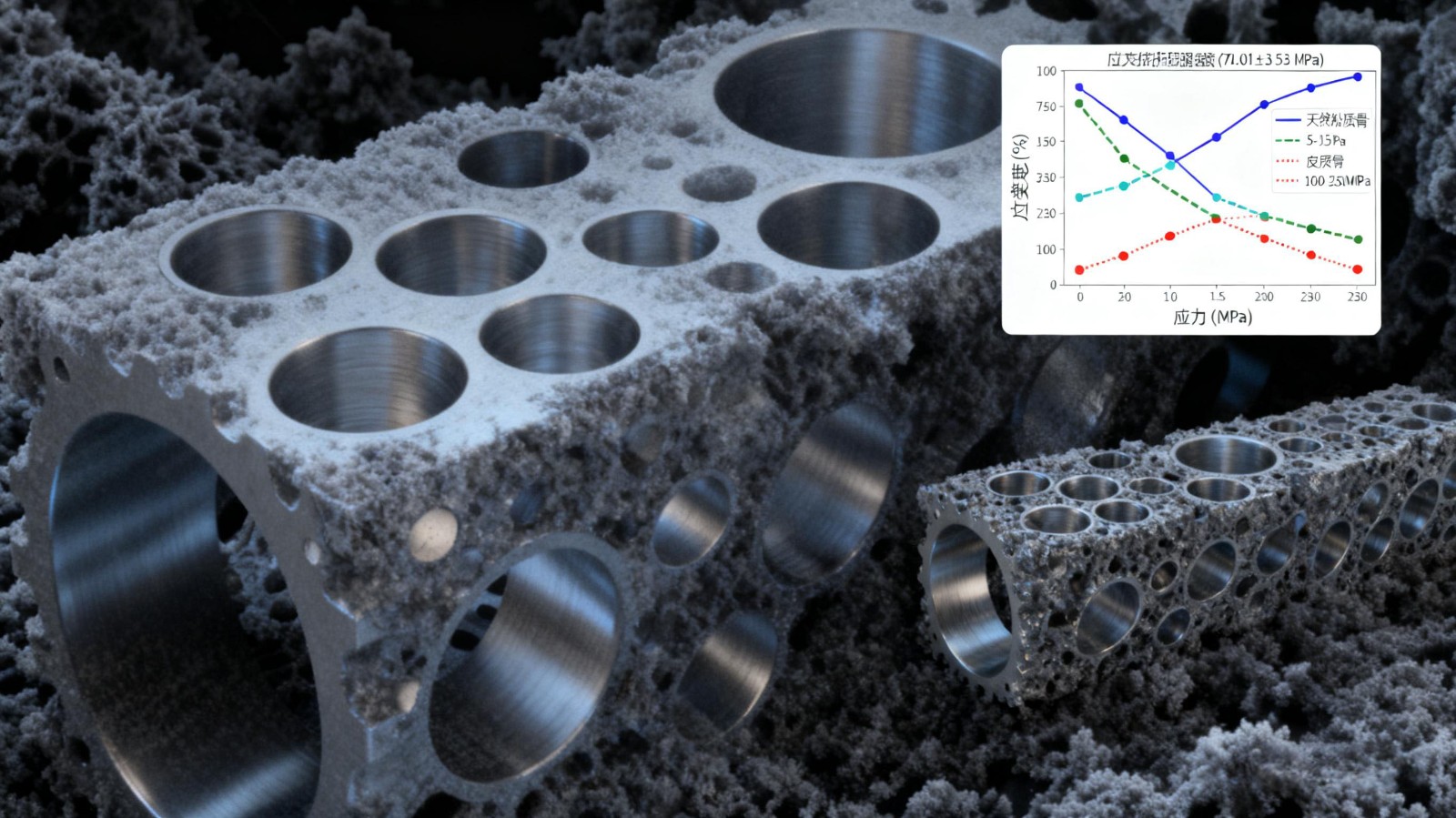
梯度孔隙设计通过模拟天然骨的力学梯度分布,有助于降低界面剪切应力集中[14]。已知人骨弹性模量为 7~30GPa,支架设计需兼顾强度,通常要求高于人致密骨的抗拉强度 50~150MPa,压缩强度 100~230MPa[15-16]。甄承栋[17] 基于竹节生物力学特征构建三周期极小曲面梯度钛支架,其 Gyroid晶胞支架(P2V1)屈服强度达 298.81MPa,与天然骨弹性模量范围高度匹配;对梯度支架进行的流体动力学仿真模拟中,Gyroid 晶胞梯度支架组的壁面剪切力相对平稳,且最适区域在 90% 以上,证明其在力学性能和渗透性上表现良好。Brett 等[18] 对骨植入仿生材料的研究发现,多孔钛结构的力学性能更接近天然骨材料,能显著增强骨-植入物界面的机械锁合和胶原纤维整合,提高剪切强度;其梯度孔隙设计减少应力集中,可避免微动导致的纤维包裹。Magré等[19] 开发的可变形钛支架在髋臼翻修术中实现术中塑形适配,在仿骨缺损模型中可实现良好贴合,梯度孔隙结构不仅实现了逐层的可塑性变形和空间填充能力,也能通过调节支柱尺寸分布来优化整体的力学响应。综合来看,如何在降低应力屏蔽的同时提升多孔钛支架的抗压强度,是未来研究的重要方向。
仿生多孔结构设计则可通过接触引导效应促进细胞定向排列。Jarolimova 等[20] 发现钛合金支架表面对 8μm 宽度的微沟显示出很强的成骨细胞接触引导作用,通过接触引导效应使成骨细胞定向排列,促进成骨分化。Lee 等[21] 进一步设计 3 种多孔网络结构,并结合微弧氧化表面改性,提升了细胞在实验初期的附着和增殖能力。动物实验表明,该支架使骨接触面积较传统方法有显著提升[22]。由此可见,适宜的仿生多孔结构不仅有利于成骨细胞的黏附与增殖,还能促进其成骨分化,为骨修复材料的设计提供新的思路。
2、表面功能化修饰提升骨整合与抗并发症能力
3DP-PTS 植入体表面功能化修饰可进一步增强其生物表面活性及骨诱导能力。现有研究表明,微弧氧化与等离子喷涂能够赋予钛表面生物活性。Ni 等[23] 在钛合金支架表面制备钙磷涂层后,材料表面接触角显著降低,表面亲水性增强,并提高了间充质干细胞的黏附密度与碱性磷酸酶活性,从而更有效地诱导和加速成骨分化。该结果证实,表面功能调控可有效增强细胞生物活性。Ma 等[24]在 3DP-PTS 上使用丝素蛋白涂层,发现其不仅改善了成骨细胞黏附与形态,还促进了成骨细胞增殖,增强了成骨细胞分化与矿化;同时,该丝素蛋白涂层显著降低了细胞凋亡率约 68%,动物模型研究显示,丝素蛋白涂层植入物的新生骨体积/孔隙体积相比于纯钛组提升了 2 倍。Wang 等[25] 开发了一种基于镁-MOF-74 载药系统和丝素蛋白的分级复合功能化 3DP-PTS。该支架通过协同且可控地释放淫羊藿苷和镁离子,有效调控了植入部位的骨免疫微环境(诱导巨噬细胞向 M2 型极化),从而同时促进成骨分化并抑制破骨活性,最终在骨质疏松条件下显著促进了植入体与宿主骨之间的骨整合。

纳米级表面形貌通过机械转导作用激活成骨通路。Yang 等[26] 指出具有纳米结构的 3D 打印钛植入体表面,能显著促进细胞黏附,细胞表面的整合素(如 α2β1)是感知植入体表面纳米拓扑结构的 关键受体。它们作为机械传导的桥梁,连接着细胞外基质(此处即植入体表面)和细胞内的骨架系统,从而触发成骨相关信号通路并促进成骨分化。Jang 等[27] 在 3DP-PTS 表面涂覆还原氧化石墨烯,利用其吸附纤维连接蛋白的特性,促进了成骨细胞的初始黏附、增殖和长期生长。钛支架亲水性的增强与纳米级拓扑结构相结合,为细胞创造了更适宜的生长和分化微环境,揭示纳米化学修饰对细胞外基质的调控作用。上述结果表明,纳米级修饰可改变植入物表面的化学和形貌特性,从而精确调控植入物与离子、生物分子及细胞的相互作用,有利于分子和细胞活性,并最终促进骨与植入体的整合。
铜、银离子掺杂可实现抗菌与促血管生成的双重效应。Cheng 等[28] 开发的铜-锶共掺钙硅酸盐涂层展现出双重生物效应,即通过释放铜离子/锶离子使金黄色葡萄球菌和大肠杆菌的菌落数量急剧减少,抗菌率显著高于钛组和硅酸钙组;同时铜锶-硅酸钙组的植入体与周围骨组织紧密结合,几乎完全被新生的骨组织和纤维组织覆盖,效果明显优于纯钛组和纯硅酸钙组,提示离子协同作用在抗菌与成骨中的时空调控价值。Wu等[29] 利用构建的聚多巴胺-铜复合涂层,实现了可控且持续的离子释放,在保留了钛合金支架本身的高力学强度的前提下,协同增强了成血管与成骨能力。Li 等[30] 将万古霉素-聚乙烯醇涂层应用于钛支架,所有植入普通钛椎间融合器的对照组兔子在 1 周内全部因严重感染死亡,手术部位出现明显化脓;而所有植入万古霉素-聚乙烯醇涂层 3DP-PTS 椎间融合器的实验组兔子全部存活,且切口逐渐愈合。该结果证明,3D 打印的多孔结构为涂层的稳定附着和药物的高效负载提供了理想的平台,该多功能涂层体系突破了传统材料的单一功能局限,实现了“抗菌骨整合”的双重作用。综上所述,3DP-PTS表面功能化修饰通过优化表面理化特性,在提升骨整合性能的同时实现对感染的有效控制,为植入体的长期稳定与功能恢复提供了有力保障。
3、生物活性分子负载的时空协同效应
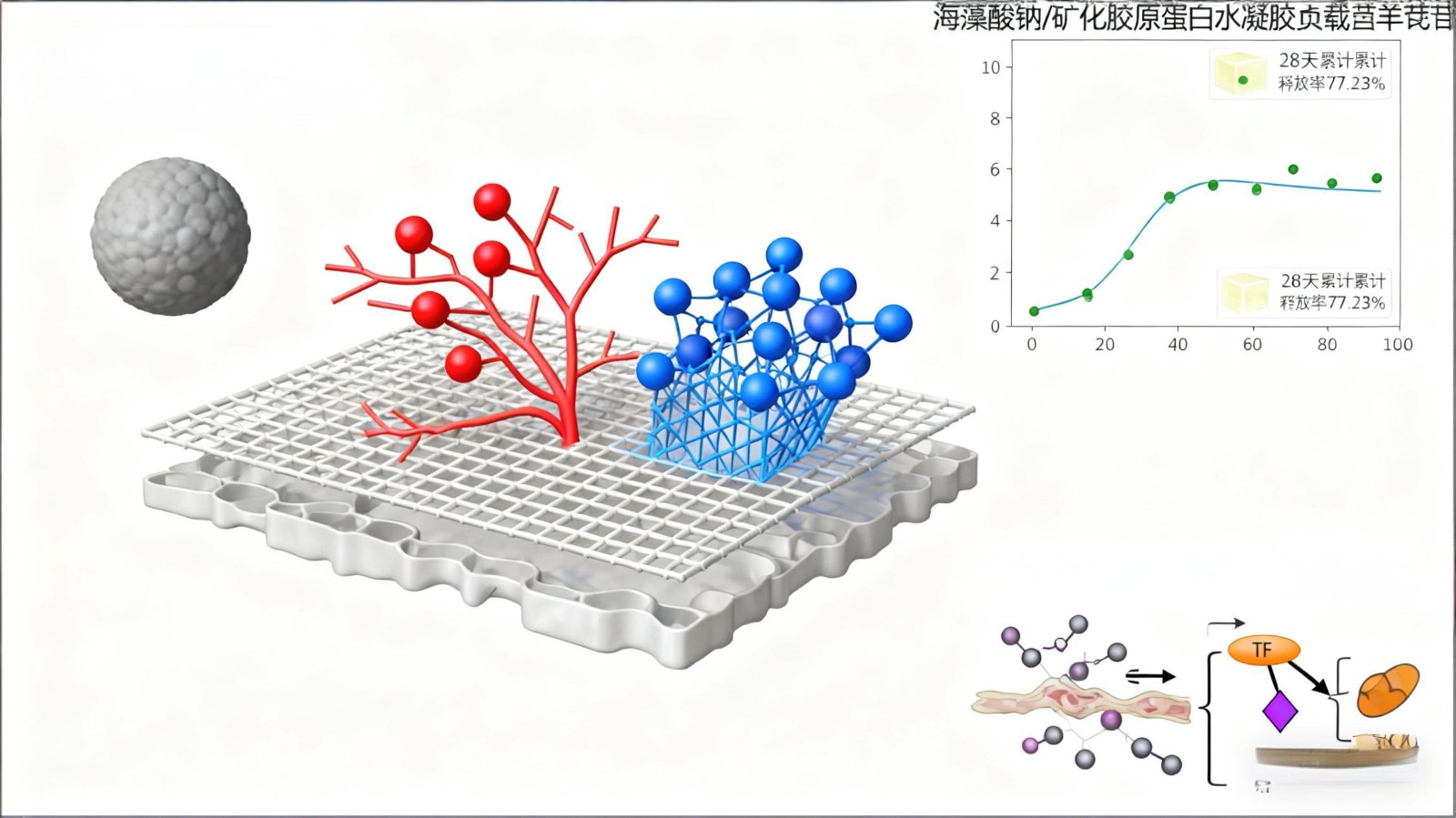
研究显示,联合海藻酸盐微珠、羟基磷灰石和骨形态发生蛋白(bonemorphogeneticprotein,BMP)-2,并结合内固定和胶原屏障膜的情况下,能够为长骨大段缺损的修复提供充分且高效的骨传导性和骨诱导性支持[31],进一步证实生长因子持续释放对骨修复具有关键作用。针对血管-成骨耦联难题,联合使用血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)与 BMP-2 可实现时序释放[32],即甲基纤维素/RGD 肽 γ-辐照藻酸盐纳米颗粒共同负载 VEGF 和 BMP-2,VEGF 早期(1~2 周内)快速释放以建立血管网络,BMP-2 后期(可持续 4~6 周甚至更久)缓慢持续释放以引导骨细胞长入和矿化;此外,借助纳米载体与先进制造技术(如 3D 打印),可实现生物因子的精确负载与释放动力学调控,从而推动时序释放模式在骨修复中的应用。Jing 等[33] 制备了一种负载辛伐他汀和水凝胶的 3D 打印钛合金支架,其缓释系统能够通过诱导铁死亡来抑制骨肉瘤细胞(143B 细胞系)的增殖和迁移,这种铁死亡依赖于转铁蛋白/NADPH 氧化酶 2 通路的激活;结果表明,该支架系统在同一局部微环境中实现了抗肿瘤治疗与骨组织再生的双重作用,验证了“修复-治疗平衡”模式的可行性。Li 等[ 34 ] 将负载淫羊藿苷的海藻酸钠/矿化胶原蛋白水凝胶填入 3DP-PTS 中,制备出海藻酸钠/矿化胶原蛋白 3DP-PTS 复合支架;海藻酸钠/矿化胶原蛋白水凝胶能有效控制淫羊藿苷的释放,28d 内累计释放率达 77.23%,避免了药物的突释效应,实现了长期、稳定的药物递送,体外研究显示该支架显著促进骨髓间充质干细胞的增殖与成骨分化,其浸提液还能增强人脐静脉内皮细胞的迁移及成管能力,并显著上调血管生成相关基因(VEGF、bFGF、HIF-1)的表达。综上,多种生物活性因子的缓释系统通过时序释放调控、分子通路激活及多效协同机制,显著提升骨缺损修复效果。这种提升不仅体现在新骨体积、骨密度和血管化水平的全面增强,同时也实现了对病理性骨微环境的有效干预,为复杂骨缺损的精准治疗提供了坚实的实验依据。

4、骨科临床应用现状
3DP-PTS 在骨缺损精准重建中展现出多维优势[35]。付君等[36-37] 通过 CT 逆向工程构建解剖适配型钛支架,针对 Paprosky Ⅲ型髋臼缺损实现个体化重建,术后 6~26 个月 Harris 平均评分从 44.0 分提升至 84.3 分,CT3D 重建显示骨-支架接触率达92.3%±2.5%,充分证实了解剖仿生设计对骨整合界面优化的显著作用。Chen 等[38] 联合采用 Masquelet技术修复感染性股骨大段缺损,分阶段实现骨缺损重建,总体愈合率达 91%,感染复发率低于 10%,且患者的假体-骨界面实现了良好的骨整合,提示该联合策略在控制感染与促进骨愈合方面具有临床可行性。Pu 等[39] 研究一种载有抗菌药物(万古霉素)和成骨因子(BMP-2)的双功能水凝胶修饰的微孔钛合金植入物,成功开发了一种具有活性氧清除、抗菌和成骨三重功能的复合植入系统,即能够有效清除感染微环境中的活性氧;持续释放万古霉素抑制细菌感染;释放 BMP-2 促进骨再生与整合;最终在感染性骨缺损模型中取得显著的骨愈合与植入物整合效果。综上,3D 打印个体化钛支架通过精准解剖适配、载药控释及多模态修复策略,显著提升复杂骨缺损重建的临床疗效,同时有效控制感染风险,为复杂骨缺损的综合管理提供了新的循证依据。
5、国内外相关产品的研发现状
随着技术的成熟,3DP-PTS 已逐步从实验室研究向商业化应用过渡,国内外多家企业推出了获批上市的产品,为骨缺损修复提供了标准化与个体化相结合的多元化解决方案。
在国外,美国 4WEBMedical 公司开发的椎间融合桁架植入物已获美国食品药品监督管理局批准,其独特的侧向桁架设计能够优化载荷分布并有效促进椎间融合[40]。意大利 AdlerOrtho 公司的TrabecularTitanium 多孔钛植入物系列采用电子束熔融技术制造,具有仿骨小梁的 3D 连通结构,广泛应用于髋、膝、肩关节翻修术中的骨缺损重建,其长期随访数据显示出良好的稳定性和骨长入效果[41]。
在国内,北京爱康医疗作为领军企业,其 3D打印髋关节臼杯、椎体及人工椎体系统先后获得国家药品监督管理局注册批准,并广泛应用于临床;其中,基于 3DACT(3D 精准构建技术)的多孔钛植入物在复杂髋臼缺损重建中展现了优异的临床效果,其不仅能有效恢复关节功能,还能降低术后并发症的发生率[42]。上海晟实医疗等公司也开发了相应的 3D 打印骨科植入物产品,推动了该技术在国内的普及。
这些已上市产品共同的特点是均采用了仿生多孔结构以确保骨整合,但其表面改性策略相对传统,功能化程度(如抗菌、促血管化)仍有较大提升空间。因此,未来产品研发需在保持结构仿生优势的同时,注重表面功能化与智能化改进,以满足临床对复杂骨缺损修复的更高需求。
6、现存挑战与未来发展方向
尽管 3DP-PTS 在骨缺损修复中展现出显著优势,但其临床转化仍面临多重技术瓶颈与科学挑战。首先,长期降解机制尚不明确。多孔钛的微动磨损颗粒可能诱发慢性炎症反应,例如,Berlinberg等[ 43 ] 报道多孔钛髋臼杯的总体无翻修生存率为81%,髋臼壳特异性生存率为 88%,无菌性失败生存率为 90%,但术后 5 年以上数据仍缺乏系统性分析。人工假体释放的钛颗粒等磨损颗粒可通过刺激炎症细胞、破坏成骨细胞与破骨细胞间的平衡,诱发周围性骨溶解[44]。因此,需建立 10 年以上的临床随访数据库,并结合组织病理学分析,明确长期植入后的生物相容性变化规律。其次,大规模生产质量控制仍是亟待解决的难题。传统数字光处理打印因纳米陶瓷颗粒引起的光散射效应,导致实际打印精度严重受损,即使设备具备微米级理论精度,成品孔径往往偏离设计值。而研究表明,有利于骨长入的理想孔径范围通常在 100~500μm,一旦孔隙偏差过大,骨长入效率便会显著下降[45]。此外,表面粗糙度的波动可能影响细胞黏附与分化行为。例如,Wang 等[46] 使用原子力显微镜测定了 4 种表面的粗糙度,粗糙表面(粗糙钛表面和负载锶的粗糙钛表面)促进了骨髓间充质干细胞的黏附、增殖和成骨分化,骨髓间充质干细胞的碱性磷酸酶活性提升。未来需开发高精度原位监测技术,例如激光干涉仪或人工智能驱动的实时反馈系统,以实现孔隙结构与表面形貌的标准化生产。
在创新方向上,智能响应型涂层的开发是重要趋势。当前研究多集中于 pH 或酶触发释药系统,Li 等[47] 设计的 pH 响应型涂层可在感染微环境下快速释放万古霉素,局部药物浓度能够快速达到高药物浓度,在早期有效杀灭细菌,并在需要时长期持续发挥细菌敏感作用。然而,此类系统的靶向性与可控性仍需提升。未来可探索多重响应机制,例如将温度敏感水凝胶与酶降解材料相结合,以实现时空精准的药物释放。
对骨再生具有关键作用。Razzi 等[48] 通过表面修饰一层具有互联微孔结构的氧化物涂层进行处理,与未处理的植入物相比,等离子体电解氧化处理显著降低了巨噬细胞的促炎反应,上调了 M2 型巨噬细胞表面标志物 CD163 的表达,并维持了抗炎因子(趋化因子 CC 配体 18)和修复因子(转化生长因子-β1)的表达;结果表明,等离子体电解氧化可主动调控宿主免疫反应,将其由促炎向促修复方向转变。Ma 等[49] 开发的智能微波响应型多功能复合支架 , 通过负载化疗药阿霉素和免疫抑制剂的ZIF-8(zeoliticimidazolateframework8)纳米材料,能高效清除原位骨肉瘤并激活强大的抗肿瘤免疫 以抑制复发;同时,借助 ZIF-8 降解释放的锌离子的成骨活性和 3D 打印钛支架的结构支撑,实现了抗肿瘤与成骨再生的双重功能。
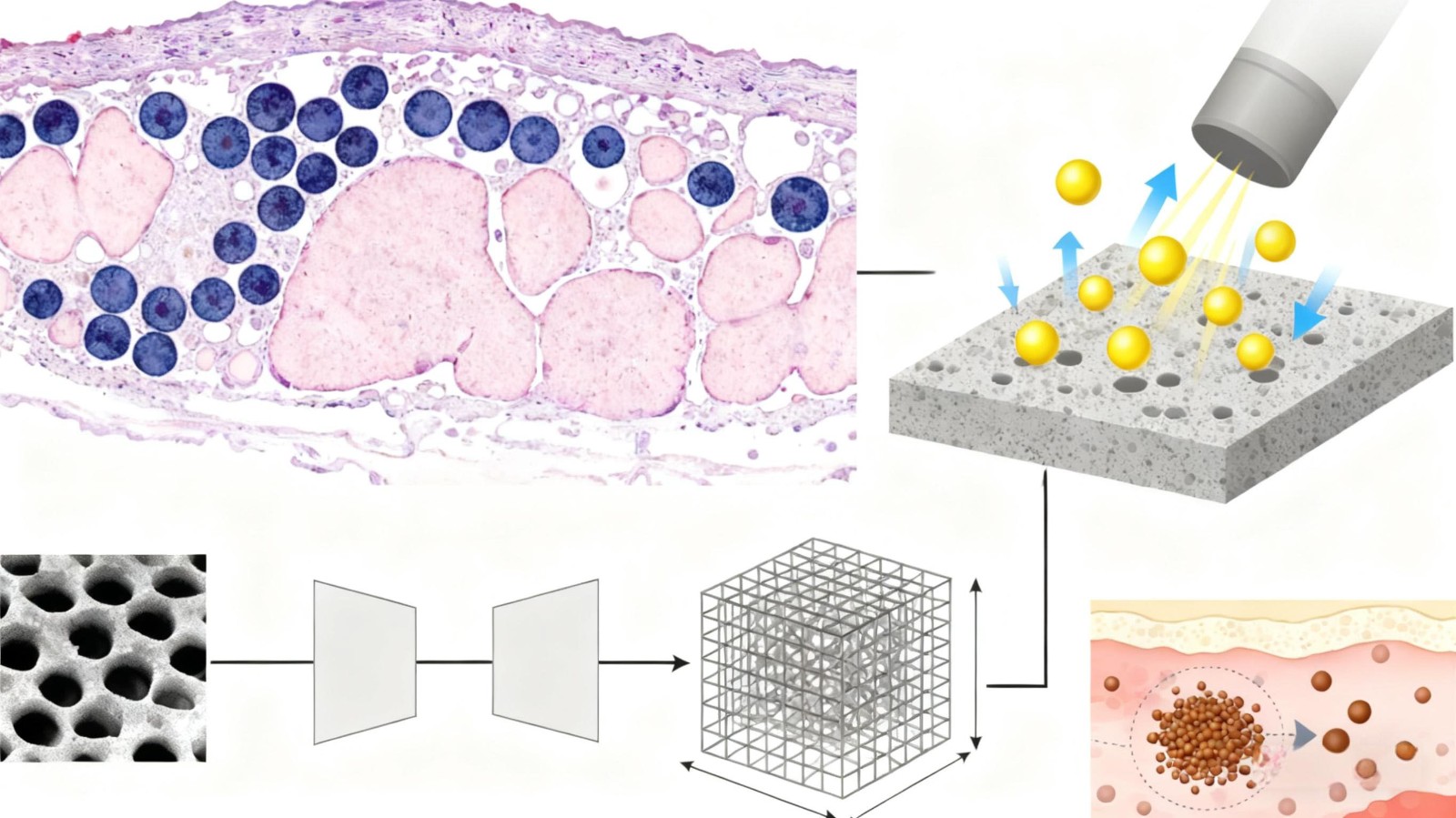
机器学习与人工智能的融合将成为推动支架设计革新的重要动力。传统试错法研发周期长,而生成对抗网络可通过分析海量生物力学数据预测最优结构参数,显著缩短研发周期[50]。Li 等[51] 利用生成对抗网络深度学习技术重建 3D 多孔材料,从2D 横截面微观结构重建多孔陶瓷材料的 3D 微观结构;通过生成对抗网络重建的微观结构与通过离子束聚焦重建实现的真实微观结构进行了比较分析,从比表面积、孔隙率和迂曲因素方面评估生成对抗网络生成的微观结构。
7、结语
3DP-PTS 通过结构-功能一体化设计,为骨缺损修复提供了从基础研究到临床应用的完整解决方案。其核心优势包括精准调控孔隙参数以模拟松质骨力学性能,减少应力屏蔽效应,同时通过表面功能化修饰和生物活性分子负载协同提升骨整合效率与抗感染能力。然而,其广泛应用仍受限于长期生物安全性、制造精度及成本效益等的挑战。因此,未来需通过多中心长期研究验证其安全性,并推动制造标准化与个体化需求的平衡,以确立其在骨科重建中的核心地位。新兴技术如智能涂层、免疫调控及人工智能的深度融合,有望突破现有技术瓶颈,推动 3DP-PTS 从实验室创新向临床常规应用的全面转化。未来临床转化需平衡制造标准化与个体化需求,推动多学科交叉创新。材料科学、免疫学与计算机科学的协同攻关,可加速智能涂层、免疫调控支架及人工智能优化设计的临床应用。同时,建立全球多中心合作网络,系统评估大规模生产的质量控制标准与成本效益比,将是实现3DP-PTS 从实验室突破向临床常规应用转化的关键。唯有通过技术创新与临床验证的双轮驱动,方能确立其在骨科修复中的核心地位,为复杂骨缺损患者提供更高效、安全的再生医学解决方案。
参考文献
1王书杰. 3D 打印纳米羟基磷灰石支架联合叶黄素在骨缺损修复中的应用研究. 南京: 南京农业大学, 2022.
2张葆鑫. 3D 打印多孔锌支架联合生物活性血清外泌体在兔桡骨骨缺损修复中的研究. 苏州: 苏州大学, 2024.
3 刘嗣聪, 刘宏治, 殷亚然. 生物可降解聚酯/生物陶瓷 3D 打印骨组织工程支架研究进展. 复合材料学报, 2024, 41(4): 1672-1693.
4刘天, 王臻, 储彬, 等. 人工软骨支架材料、结构设计与制备技术研究进展. 功能材料, 2023, 54(3): 3001-3011.
5汪雪颖, 许建霞, 李岩. 3D 打印多孔钽表面改性及功能化研究进展. 表面技术, 2023, 52(7): 1-10, 54.
6王树棋, 王亚明, 邹永纯, 等. 微弧氧化涂层微纳米孔调控及功能化应用研究进展. 表面技术, 2021, 50(6): 1-22.
7Zhang Y, Sun N, Zhu M, et al. The contribution of pore size and porosity of 3D printed porous titanium scaffolds to osteogenesis.Biomater Adv, 2022, 133: 112651.
8Mukasheva F, Adilova L, Dyussenbinov A, et al. Optimizing scaffold pore size for tissue engineering: insights across various tissue types. Front Bioeng Biotechnol, 2024, 12: 1444986.
9邓富元. 3D 打印不同几何形状孔隙的钛合金支架对骨长入影响研究. 泸州: 西南医科大学, 2021.
10王永成. 3D 打印多孔钛内植物的制备及其骨长入性能评估. 呼和浩特: 内蒙古自治区人民医院, 2019.
11鲁斌. 3D 打印多孔钛合金支架孔隙结构对骨长入效果影响的动物实验研究. 衡阳: 南华大学, 2020.
12邓威, 郑欣, 谌业帅, 等. 3D 打印多孔钛材料修复兔股骨髁骨缺损的实验研究. 实验动物与比较医学, 2017, 37(4): 266-272.
13Luo K, Wang L, Chen X, et al. Biomimetic polyurethane 3D scaffolds based on polytetrahydrofuran glycol and polyethylene glycol for soft tissue engineering. Polymers (Basel), 2020, 12(11):2631.
14武琦, 李小康, 汤臻, 等. 3D 打印干骺端骨修复支架的生物力学优化设计. 医用生物力学, 2025, 40(2): 477-484.
15何远怀. 羟基磷灰石/Ti-13Nb-13Zr 生物材料的制备和性能研究.昆明: 昆明理工大学, 2018.
16Arifin A, Sulong AB, Muhamad N, et al. Material processing of hydroxyapatite and titanium alloy (HA/Ti) composite as implant materials using powder metallurgy: a review. Mater Design, 2014,55: 165-175.
17甄承栋. TPMS 多孔梯度支架的设计及其性能研究. 济南: 齐鲁工业大学, 2025.
18Brett E, Flacco J, Blackshear C, et al. Biomimetics of bone implants:the regenerative road. Biores Open Access, 2017, 6(1): 1-6.
19Magré J, Willemsen K, Kolken HMA, et al. Deformable titanium for acetabular revision surgery: a proof of concept. 3D Print Med,2023, 9(1): 16.
20Jarolimova P, Voltrova B, Blahnova V, et al. Mesenchymal stem cell interaction with Ti6Al4V alloy pre-exposed to simulated body fluid. RSC Adv, 2020, 10(12): 6858-6872.
21Lee UL, Yun S, Lee H, et al. Osseointegration of 3D-printed titanium implants with surface and structure modifications. Dent Mater, 2022, 38(10): 1648-1660.
22Zhang J, Jiang Y, Shang Z, et al. Biodegradable metals for bone defect repair: a systematic review and meta-analysis based on animal studies. Bioact Mater, 2021, 6(11): 4027-4052.
23Ni R, Jing Z, Xiong C, et al. Effect of micro-arc oxidation surface modification of 3D-printed porous titanium alloys on biological properties. Ann Transl Med, 2022, 10(12): 710.
24Ma XY, Ma TC, Feng YF, et al. Promotion of osteointegration under diabetic conditions by a silk fibroin coating on 3D-printed porous titanium implants via a ROS-mediated NF-κB pathway.Biomed Mater, 2021, 16(3): 035008.
26Wang W, Xiong Y, Zhao R, et al. A novel hierarchical biofunctionalized 3D-printed porous Ti6Al4V scaffoldwith enhanced osteoporotic osseointegration through
osteoimmunomodulation. J Nanobiotechnology, 2022, 20(1): 68.
26 Yang S, Jiang W, Ma X, et al. Nanoscale morphologies on the surface of 3D-printed titanium implants for improved osseointegration: a systematic review of the literature. Int J Nanomedicine, 2023, 18: 4171-4191.
27Jang HJ, Kang MS, Jang J, et al. Harnessing 3D printed highly porous Ti-6Al-4V scaffolds coated with graphene oxide to promote osteogenesis. Biomater Sci, 2024, 12(21): 5491-5503.
28Cheng XQ, Xu W, Shao LH, et al. Enhanced osseointegration and antimicrobial properties of 3D-printed porous titanium alloys with copper-strontium doped calcium silicate coatings. J Biomater Appl,2025, 39(6): 607-619.
29Wu HY, Lin YH, Lee AK, et al. Combined effects of polydopamineassisted copper immobilization on 3D-printed porous Ti6Al4V scaffold for angiogenic and osteogenic bone regeneration. Cells,2022, 11(18): 2824.
30Li Y, Li L, Ma Y, et al. 3D-printed titanium cage with PVAvancomycin coating prevents surgical site infections (SSIs).Macromol Biosci, 2020, 20(3): e1900394.
31Lee S, Park H, Yun HS, et al. Alginate beads encapsulating hydroxyapatite microparticle and BMP-2 for long bone defect regeneration: a pilot study. In Vivo, 2025, 39(2): 732-741.
32Jiang H, Zhang M, Qu Y, et al. Therapeutic potential of nanosustained-release factors for bone scaffolds. J Funct Biomater, 2025,16(4): 136.
33Jing Z, Yuan W, Wang J, et al. Erratum: simvastatin/hydrogelloaded 3D-printed titanium alloy scaffolds suppress osteosarcoma via TF/NOX2-associated ferroptosis while repairing bone defects.Bioact Mater, 2024, 34: 463-465.
34Li S, Cui Y, Liu H, et al. Dual-functional 3D-printed porous bioactive scaffold enhanced bone repair by promoting osteogenesis and angiogenesis. Mater Today Bio, 2024, 24: 100943.
35吴子健, 胡昭端, 谢有琼, 等. 3D 打印技术与骨组织工程研究文献计量及研究热点可视化分析. 中国组织工程研究, 2021, 25(4):564-569.
36付君, 倪明, 陈继营, 等. 个性化 3D 打印多孔钛合金加强块重建重度髋臼骨缺损的早期临床疗效研究. 中华骨与关节外科杂志,2018, 11(6): 401-407.
37付君. 个性化 3D 打印多孔钛合金加强块重建重度髋臼骨缺损的应用基础及早期临床疗效研究. 北京: 中国人民解放军医学院, 2018.
38Chen Z, Xing Y, Li X, et al. 3D-printed titanium porous prosthesis combined with the Masquelet technique for the management of large femoral bone defect caused by osteomyelitis. BMC Musculoskelet Disord, 2024, 25(1): 474.
39Pu Y, Lin X, Zhi Q, et al. Microporous implants modified by bifunctional hydrogel with antibacterial and osteogenic properties promote bone integration in infected bone defects. J Funct Biomater, 2023, 14(4): 226.
40Hunt JP, Begley MR, Block JE. Truss implant technology™ for interbody fusion in spinal degenerative disorders: profile of advanced structural design, mechanobiologic and performance characteristics. Expert Rev Med Devices, 2021, 18(8): 707-715.
41Geng X, Li Y, Li F, et al. A new 3D printing porous trabecular titanium metal acetabular cup for primary total hip arthroplasty:a minimum 2-year follow-up of 92 consecutive patients. J Orthop Surg Res, 2020, 15(1): 383.
42张彦超, 李建军, 侯文韬, 等. 3D 打印多孔钛钢板一体化植入体修复髋臼后壁粉碎性骨折合并骨缺损的初步研究. 中国骨伤,2019, 32(5): 469-474.
43Berlinberg EJ, Kavian JA, Roof MA, et al. Minimum 2-year outcomes of a novel 3D-printed fully porous titanium acetabular shell in revision total hip arthroplasty. Arthroplast Today, 2022, 18:39-44.
44Wei X, Fan B, Chen X, et al. DAPT inhibits titanium particleinduced osteolysis by suppressing the RANKL/Notch2 signaling pathway. J Biomed Mater Res A, 2020, 108(11): 2150-2161.
45He J, Xie M, Luo S, et al. Advanced dynamic slurry circulation system for precision 3D bioprinting of osteogenic ceramics:enhanced stability, mechanical performance optimization, and in vitro bioactivity validation. ACS Omega, 2025, 10(30): 32895-32906.
46Wang X, Xin H, Ning X, et al. Strontium-loaded titanium implant with rough surface modulates osseointegration by changing sfrp4 in canonical and noncanonical Wnt signaling pathways. Biomed Mater, 2022, 17(3): 35012.
47Li D, Tang G, Yao H, et al. Formulation of pH-responsive PEGylated nanoparticles with high drug loading capacity and programmable drug release for enhanced antibacterial activity.Bioact Mater, 2022, 16: 47-56.
48Razzi F, Fratila-Apachitei LE, Fahy N, et al. Immunomodulation of surface biofunctionalized 3D printed porous titanium implants.Biomed Mater, 2020, 15(3): 035017.
49Ma L, Zhou J, Wu Q, et al. Multifunctional 3D-printed scaffolds eradiate orthotopic osteosarcoma and promote osteogenesis via microwave thermo-chemotherapy combined with immunotherapy.Biomaterials, 2023, 301: 122236.
50Li Y, Qiao Y, Ma Y, et al. AI in fungal drug development:opportunities, challenges, and future outlook. Front Cell Infect Microbiol, 2025, 15: 1610743.
51Li X, Zhou S, Liu X, et al. 3D microstructure reconstruction and characterization of porous materials using a cross-sectional SEM image and deep learning. Heliyon, 2024, 10(20): e39185.
收稿日期:2025-03-22 修回日期:2025-10-13
(注,原文标题:3D打印多孔钛支架修复骨缺损的临床转化与挑战)
无相关信息


yongyiti.com
永益钛手机网