- 2022-07-25 06:56:38 医用镍钛合金可制造高性能植入医疗器械 市场发展空间大
1 、前 言
随着人口的老龄化, 现代医学界对医用金属材料需求与日俱增[1,2] 。 镍钛合金因其优异的超弹性、 形状记忆性和生物相容性[3,4] , 已广泛应用于人工关节、 牙科植入、 心血管支架等植入领域, 成为了理想的生物医用金属材料[5-8] 。 但由于该合金长期使用不可避免地会被腐蚀, 导致镍离子释放到生理环境中, 严重制约了镍钛合金作为医用植入体材料的发展[9-11] , 因此为了提高植入体的安全可靠性, 需对镍钛合金表面进行处理。 本文对镍钛合金医用性能进行了总结, 并重点介绍了不同表面改性技术的研究进展, 同时对未来镍钛合金表面改性技术的发展进行了展望, 为后期的深入研究提供参考。
2 、镍钛合金性能特征
2. 1 物理机械性能
镍钛合金作为医用植入体, 首先要考虑其力学性能。
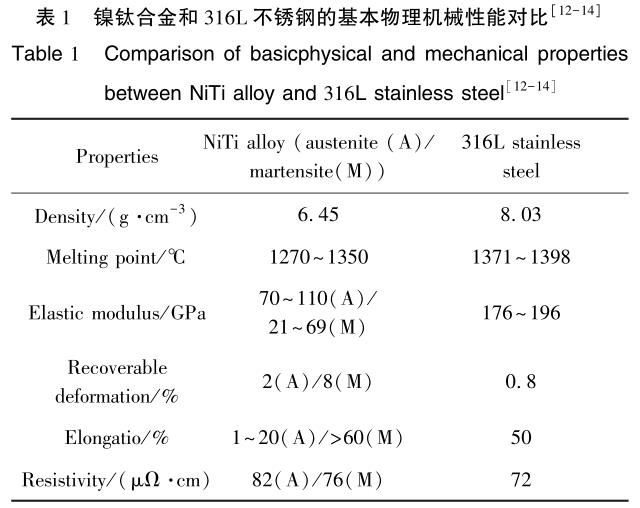
对镍钛合金和医用 316L 不锈钢的基本物理机械性能进行对比, 如表 1 所示[12-14] 。 从表中可以看出镍钛合金密度比 316L 不锈钢的小, 弹性模量也与人骨相近, 甚至可恢复形变能力达到了 8%[15] 。 因此在以镍钛合金为原材料时, 植入体的应力屏蔽问题显著减少[16,17] 。 这意味着植入体在使用过程中不需要吸收大部分外力, 有利地促进了镍钛合金在人体内的广泛应用。
2. 2 超弹性
所谓的超弹性, 就是通过机械诱导的外力作用引起镍钛合金马氏体相变[18] 。 当外力作用时, 镍钛合金发生形变; 当外力卸载后, 镍钛合金形变消失恢复原状。 从宏观的角度来说, 材料能在较大的应变范围内保持内应力基本不变[19,20] 。 镍钛合金应力-应变与骨骼及肌腱的应力-应变行为非常相似, 呈现非线性关系, 如图 1 所示[21] 。 这使得以镍钛合金为基体的植入体在人体中可以加快伤口愈合, 减小植入体对组织造成的创伤[22,23] 。
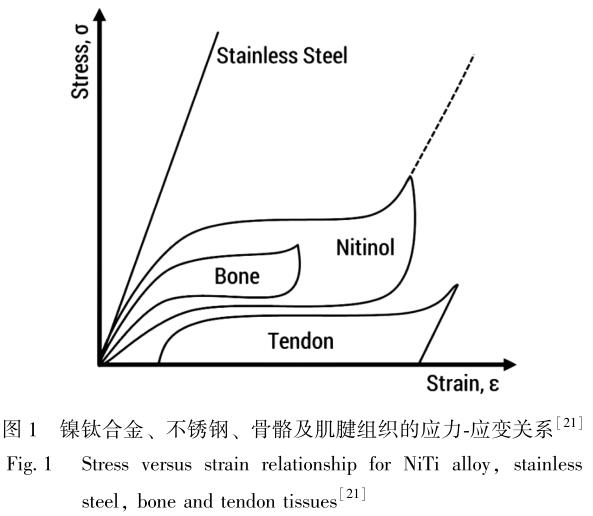
镍钛合金的应力-应变温度曲线展示了其超弹性演变过程, 如图 2 所示[24] 。 镍钛合金在原点 O 处处于奥氏体状态, 在没有外加应力的情况下以孪晶形态沿路径OA 冷却, 并通过相变点 Af、 As、 Ms 和 Mf。 从 A 点到 B点发生去孪生及重新取向的形变, 从 B 点到 C 点则进行弹性卸载[25,26] 。 当加热到 Af 以上相变从 O 点加载到 E点时, 镍钛合金可通过应力诱发马氏体相变, 从而获得高达 11%的应变[26] 。 只要不达到永久变形点, 材料就会恢复超弹性, 回到奥氏体态[27,28] 。
2. 3 形状记忆性
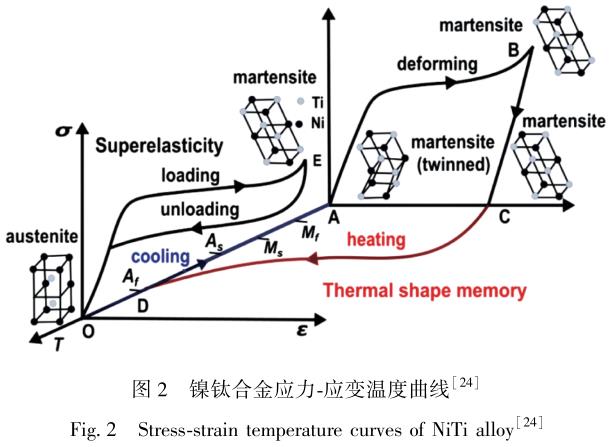
镍钛合金具有传统的单程、 双程甚至全程形状记忆效应, 这些效应都植根于其相变特性[29,30] 。 当合金发生形变时, 可通过施加外部载荷或改变温度来诱导, 使它恢复塑性形变回到原始形状。镍钛合金经过外力作用训练后可得到双程形状记忆效应, 如图 3 所示[19] 。 而该合金经过训练的最大可恢复形变达 9% ~ 10%, 大于单程记忆效应的最大恢复形变量[31] 。 因此, 在矫正外科领域, 常常利用镍钛合金的形状记忆效应, 控制合金相变温度使它接近人体环境温度,使它植入人体后自动恢复至预定形状[32,33] 。
2. 4 生物相容性
生物相容性是指植入体在人体内引起适当反应和产生有效协作的能力[34] 。 其中, 生物相容性包括组织相容性、 血液相容性和力学相容性, 三者密切相关但又各有侧重。 组织相容性是植入体与生物组织, 如皮肤、 肌肉、骨骼等的相互适应的能力, 常常以植入体组成元素的细胞毒性来评估[35] 。 而镍钛合金组织相容性的重点在于镍元素的释放是否会在人体内引发副作用, 国内外研究人员对此进行了大量研究。 林钟石等[36] 对热氧化处理后的镍钛合金进行细胞毒性试验、 溶血试验、 血栓形成试验、遗传毒性试验等一系列生物安全研究, 结果表明镍钛合金的生物安全性符合规范要求。 Liu 等[37] 在镍钛合金表面制备包含镍、 钛、 氧元素的纳米管, 研究得出镍元素的释放量对细胞相容性影响不大。
血液相容性的优劣程度是影响植入体功能的一个重要指标。 所谓血液相容性, 就是指植入体在人体血液中引起正常生物反应, 保持有效生物功能的能力[38] 。 随着对镍钛合金医用材料需求的不断增长, 血液相容性受到的关注度也越来越高, 其性能一般从抗凝血和不损伤血液功效两方面来判断[39,40] 。 大多数医用金属材料的血液相容性都比较差, 因为蛋白质和血小板容易吸附在带正电的材料表面, 造成感染或血栓等不良反应[41,42] , 因而表面结构及元素组成是决定植入体生物相容性的关键。
生物力学相容性包括植入材料力学性能与人体组织相匹配、 共存、 协调的能力[43] 。 由于金属植入体弹性模量跟人骨相比差异较大, 这种不连续的力学性能可能会在人体内形成应力屏蔽, 导致植入体遭受体液腐蚀、 摩擦失效以及疲劳破坏等[44,45] , 因此对于弹性模量的研究与评价成为了医用金属材料的重点研究方向。 而镍钛合金具有跟骨骼及肌肉相似的弹性模量和应力-应变行为,通过表面改性技术可以大大提高其生物相容性, 使该合金更广泛地应用于介入医疗领域。
3、 提高耐蚀性和生物相容性的表面改性
研究表明, 镍钛合金在人体中不可避免地会被腐蚀,释放的镍离子可诱发过敏和慢性炎症, 严重影响植入材料的性能[46,47] 。 而血液相容性作为衡量镍钛合金植入体性能的 重 要 指 标, 其 主 要 影 响 因 素 包 括 表 面 微 纳 结构[48] 、 元素成分[49] 等。 人体环境中, 植入体血液相容性能优异时, 血小板不易损伤和黏附在材料表面, 可有效缓解血栓的形成[50,51] 。 此外, 特定的元素组成及表面形貌更利于细胞的增殖分化[52] 。 通过调整合金表面的微纳结构、 元素组成, 可以在保持耐蚀性以及减少镍离子析出的情况下实现植入物血液相容性的提升[53,54] 。 目前,国内外学者大多采用电火花表面改性、 激光诱导、 阳极氧化、 自组装合成及化学改性这 5 种表面改性技术来提高镍钛合金的耐蚀性和生物相容性。
3. 1 电火花表面改性
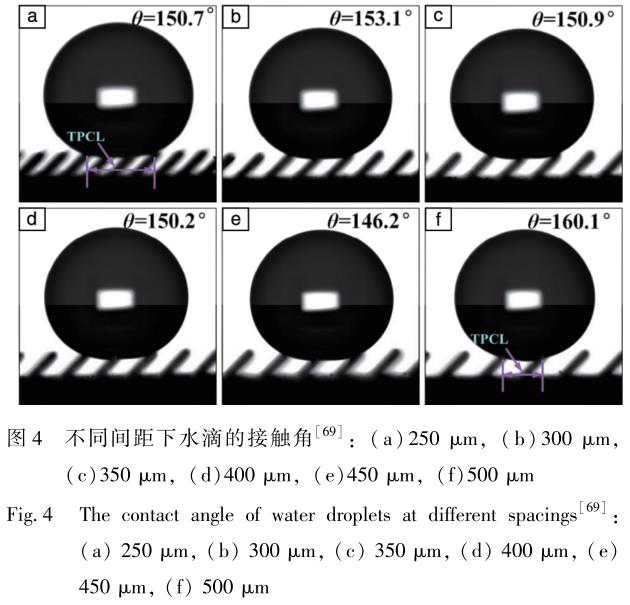
电火花加工是基于在绝缘工作介质中的两极间产生脉冲放电来电蚀加工导电材料的一种技术方法[55] 。 镍钛合金具有导热系数低[56] 、 延展性好[57] 、 粘度高[58] 的特点, 使用电火花加工有利于放电热量有效集中和利用[59,60] 。 冯超超等[61] 采用磁力搅拌电火花加工技术制备镍钛合金的疏水表面。 在电火花加工中使用磁力搅拌技术可以稳定加工过程, 提高加工效率, 并且有效缓解电极损耗及异常放电情况[62,63] 。 而且由于疏水表面具有独特的自洁性、 低粘附性等特点[64-66] , 可以通过表面改性技术使镍钛合金材料表面转变成疏水状态。 这样植入体在阻碍细菌粘附、 降低感染风险[67] 、 减少蛋白质及血小板的粘附和改善血液相容性方面可获得巨大的提升[68] 。 当电流为 1. 5A、 脉宽为 60μs 时, 可在镍钛合金表面形成凝固鼓包-凹坑-气孔-颗粒的复合形貌, 最大接触角达到 138. 2°, 大幅提升镍钛合金表面的疏水性。
为了探究不同结构尺寸参量对疏水性的影响, 实现镍钛合金疏水表面的大规模可控制备。 Hou 等[69] 受蝴蝶翅膀微观结构的启发, 采用电火花线切割技术在镍钛合金表面制备了不同间距的可控各向异性倾斜微柱, 如图 4 所示[69] , 并观察其静态接触角。 结果表明, 当支撑水滴的柱子数量相同时, 水滴的接触角随间距的增加而减小。 具有倾斜微柱结构的镍钛合金表面最大接触角可达 160. 1°, 比光滑表面提高了约 78%, 大幅提高了镍钛合金表面抗菌性。
3. 2 激光诱导
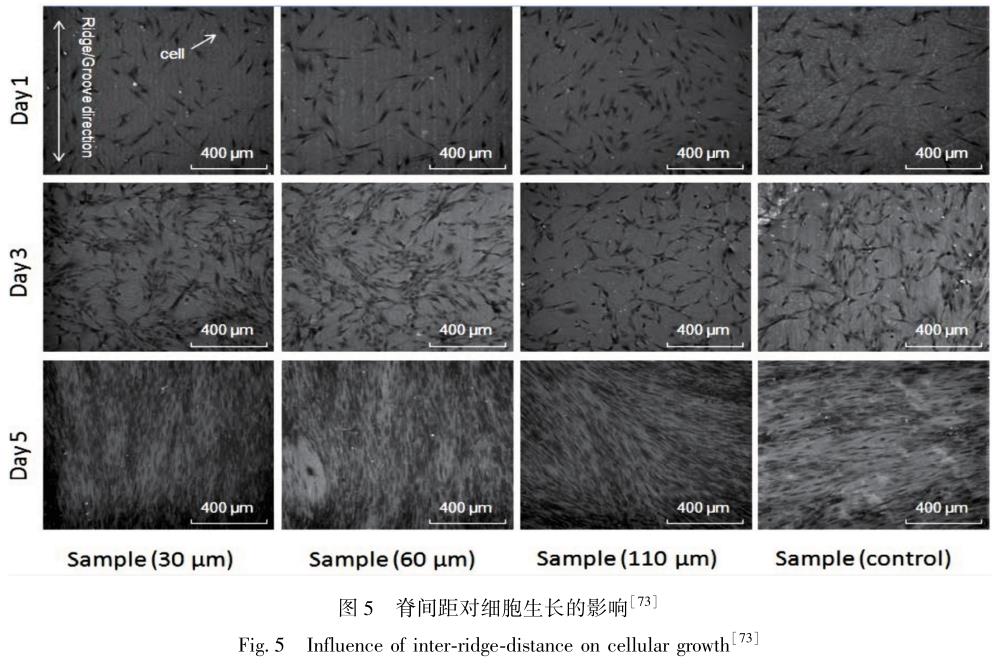
激光诱导是将高能激光光束聚焦在待加工表面, 并与它发生相互作用, 通过热效应实现表面材料的去除或烧蚀, 从而达到表面改性的目的[70-72] 。 Zhou 等[73] 用脉冲激光在镍钛合金表面烧蚀出不同尺寸间距的沟槽, 并探究在不同尺寸脊间距下人体细胞排列和黏附行为, 如图 5所示[73]。 在脊间距为 30 和 60μm 的凹槽上时, 干细胞沿平行槽方向排列生长。 而在脊间距为 110μm 的凹槽上时,干细胞偏离槽方向生长。 这是由于凹槽两侧镍钛合金约束的影响, 人体细胞在脊间距为 110μm 的凹槽上更易运动扩张。 因此, 激光织构的脊间距为 30 和 60μm 的凹槽时对人体细胞排列具有更好的控制能力[74,75]。
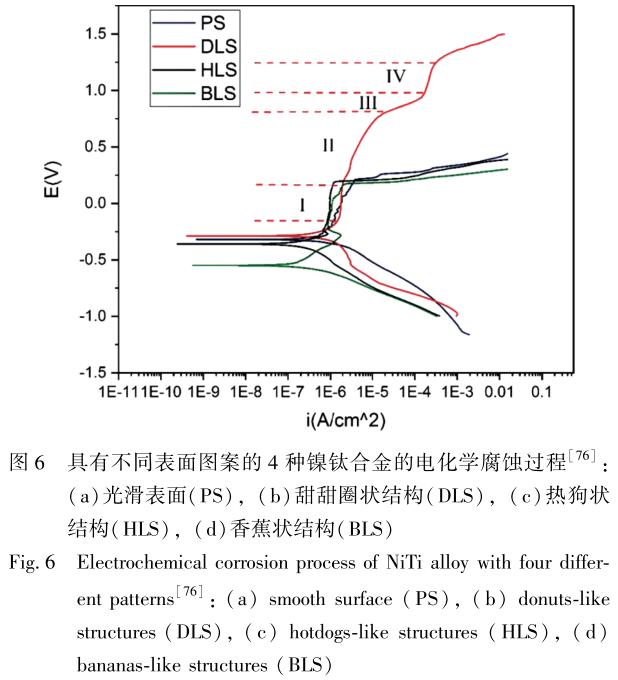
Cui 等[76] 在镍钛合金表面用新型纳秒激光辐照技术加工出香蕉状、 热狗状、 甜甜圈状 3 种不同形状的结构,并将它与具有光滑表面的镍钛合金进行电化学腐蚀实验对比, 如图 6 所示。 与镍钛合金表面其他图案样品相比,甜甜圈状表面具有最好的耐腐蚀性能。 Zhang 等[77] 使用激光冲击强化(laser shock peening, LSP)技术对镍钛合金进行处理。 细胞培养研究表明, 经过处理的样品具有较低的细胞毒性和较高的细胞存活率, 并且显著地降低了初始镍离子释放速率。 在模拟体液中的电化学测试和浸泡试验表明, LSP 技术增强了镍钛合金耐腐蚀性, 提高了钙沉积速率。 另外, 经 LSP 处理后, 镍钛合金硬度由(226±3)HV 提高到(261±3)HV, 改善了它在生物医学应用中的力学性能。
3. 3 阳极氧化
阳极氧化是通过外加电场将金属置于电解液中作为阳极, 进行氧化的电化学过程, 是一种广泛使用的表面改性技术[78,79] 。 Yang 等[80] 在含氟离子的乙二醇阳极电解液中对镍钛合金进行处理, 并在合金表面形成了具有均匀孔状分布的纳米级氧化物。 阳极氧化后的镍钛合金表面形成的氧化层主要由二氧化钛组成, 镍含量显著降低, 但形成的孔隙的大小和形状受到反应条件的影响。
此外, 经阳极氧化处理后的镍钛合金表面对大肠杆菌的抑菌活性也有所提高。
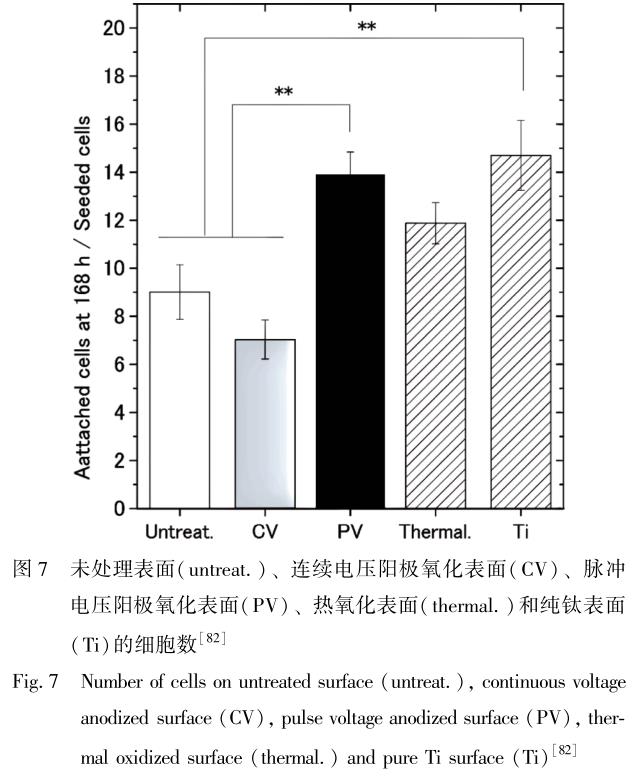
为了抑制镍钛合金阳极氧化过程中产生的点蚀现象,减少孔隙生成及镍离子释放[81] , Ohtsu 等[82] 创新性地采用了脉冲硝酸电解质的阳极氧化技术。 硝酸与合金产生钝化反应, 形成厚度约为 50nm 的无孔无镍的二氧化钛层, 提高了镍钛合金的亲水性和耐腐蚀性。 这种新形成的二氧化钛表面使镍钛合金表面镍离子释放速率显著减小, 进一步增强了细胞在其表面的增殖速率。 图 7 为未处理表面、 连续电压阳极氧化表面、 脉冲电压阳极氧化表面、 热氧化表面以及纯钛表面的细胞数量的对比。 细胞实验表明, 在 168h 的培养期内, 经脉冲电压阳极氧化处理后的表面细胞增殖率比未经处理的表面高约 1. 5 倍。
这些显著优势表明, 在硝酸电解液中的脉冲阳极氧化是一种创新的表面改性工艺, 克服了镍钛合金相关的关键缺陷, 增强了其生物相容性[82] 。
3. 4 自组装合成
自组装技术依靠弱共价键、 氢键、 离子键、 范德华力等分子间作用力在金属表面构建出一种通用、 廉价且高效的生物活性表面[83,84] 。 壳聚糖作为一种具有良好抗菌性、 吸附性、 生物相容性的天然有机化合物[85] , 在医用领域具有很高的应用价值。 Ying 等[86] 将硫酸葡聚糖/壳聚糖通过层层自组装技术接枝到以镍钛合金为衬底的氮化钛涂层上, 形成的氮化钛涂层和硫酸葡聚糖/ 壳聚糖多层膜使得镍离子的释放量明显降低。 细胞实验表明该表面修饰工艺有利于成骨细胞在镍钛合金表面的生长。
Milošev 等[87] 在氧化物覆盖的镍钛合金表面自组装形成了十八烷基膦酸酯共价键合膜。 通过测量分析镍钛/ 十八烷基膦酸酯界面结构及带电十八烷基膦酸酯/ 溶液界面结构, 可知生成的十八烷基膦酸酯界面强度稳定且耐腐蚀,有效阻碍了镍离子的释放。 Zhao 等[88] 通过氢氧化钾溶液与镍钛合金发生的碱腐蚀反应, 在镍钛合金表面生长出以二氧化钛、 氢氧化镍和钛酸钾为主的纳米薄片, 从而使合金获得了良好的细胞功能和免疫微环境。 实验结果分析表明, 在室温条件下, 经碱腐蚀处理后的样品可显著促进内皮细胞的功能, 如增殖、 迁移、 一氧化氮产生、 血管内皮生长因子分泌和血管生成。 此外, 在 15mol·L-1 氢氧化钾中生长的自组装纳米片可以直接或间接将巨噬细胞转换为抗炎 M2 表型, 加快支架的再内皮化, 从而解决相关的并发症。
3. 5 化学改性
通过化学处理, 利用钛元素对氧元素的高结合亲附力[89] , 在镍钛合金表面形成生物活性优异且耐腐蚀的无镍二氧化钛改性层[90] 。 Sharma 等[91] 用去离子水、 氢氟酸和硝酸组成的溶液对镍钛合金表面进行氧化处理。 经过处理的表面与未处理的表面相比, 更容易形成无镍二氧化钛层。 Huang 等[92] 在镍钛合金表面采用去合金化制备了二氧化钛纳米孔涂层。 低温去合金化处理可以得到表面深度为 130nm 的无镍二氧化钛, 大幅减少了镍离子的释放。 对处理前后的镍钛合金进行直接接触法和干细胞体外分离培养法的细胞实验, 结果表明, 具有无镍二氧化钛纳米孔涂层的植入体可以避免人体过敏, 并改善镍钛合金的生物相容性。
4、镍钛合金表面复合改性
研究发现, 尽管采用了不同的改性技术在镍钛合金表面构建出活性微纳结构层, 但是所构建的结构层不稳定, 易失效[93,94] 。 例如, 激光诱导的镍钛合金表面存在裂纹[95] , 并对周围环境产生依赖且随时间的变化而自然老化[96] , 使得这类镍钛合金改性表面在人体内的可靠性受到限制。 此外, 在高温或腐蚀性液体相互作用下合金易损坏[97,98] 。 在激光加工表面涂覆低表面能的化学层被认为是提高超疏水表面加工效率和稳定性的常用方法[99] 。 Yang 等[100] 为了进一步提高镍钛合金的耐蚀性和生物相容性, 提出了采用激光辐照和聚二甲基硅氧烷复合改性方法制备接触角为 155. 4°±0. 9°、 滑动角为 4. 4°±1. 1°的超疏水表面。 聚二甲基硅氧烷超疏水表面表现出优异的防腐性能。 镍离子释放实验也表明, 此复合改性方法有效地抑制了镍离子在电解液和模拟体液中的游离,大大增强了镍钛合金生物相容性。
然而, 在激光诱导表面涂覆低表面能化学层的复合改性过程中, 制备的表面可能会受到有毒物质的污染,如氟烷基硅烷和硬脂酸[101,102] 。 受到污染的镍钛合金功能表面对人体生物环境的副作用限制了其应用价值[103] 。
Wang 等[104] 通过纳秒激光去除混合碳离子注入的方法,在镍钛合金衬底上仅用 16h 就快速制备出绿色环保的超疏水表面。 与单一的激光诱导相比, 该方法具有较高的效率。 通过机械磨损试验发现, 碳离子注入后表面组织的力学性能得到提高, 表现出良好的结构稳定性。为保持镍钛合金形状记忆和超弹性特征, 同时防止血小板的过度黏附和聚集, Witkowska 等[32] 采用低温等离子体氧化和射频化学气相沉积工艺相结合的方法制备了氮和氢改性的非晶碳涂层(a-CNH) 与二氧化钛复合表面层。 这种复合结构增强了材料的耐腐蚀性, 并且表面的低粗糙度和化学成分有效降低了血小板的粘附性和聚集性, 改善了镍钛合金的生物相容性。
5、 结 语
尽管具有超弹性、 形状记忆性以及良好物理机械性与生物相容性的镍钛合金是介入医疗领域应用最为广泛的金属材料, 但它会在生理环境中被腐蚀而释放镍离子,导致过敏和慢性炎症, 引发人体生物安全风险。 同时血液组元易吸附在带正电的材料表面, 造成血栓等不良反应。 因此, 通过表面改性技术改善镍钛合金植入体的耐蚀性和生物相容性是非常重要的。 近年来, 研究者们开发了许多先进的表面改性技术, 如电火花表面改性、 激光诱导、 阳极氧化、 自组装以及化学改性等。 虽然这些表面改性技术可以在很大程度上改善镍钛合金植入体的性能, 但仍存在许多问题, 如制备成本高, 制备方法对人体有害, 工艺过程不稳定等。 鉴于此, 对镍钛合金表面改性总结及展望如下。
(1)随着对镍钛合金植入体的需求不断增长, 具有低成本和可大规模生产的表面改性技术获得越来越多的重视。 同时, 随着对微铣削加工的深入研究, 该加工技术凭借高精度、 高效率、 低成本等诸多优势在机械制造中得到广泛应用。 将微铣削技术应用于镍钛合金表面改性, 并探究微结构参数对表面润湿性的影响, 实现疏水表面的大规模可控制备是很有必要的。
(2)随着对镍离子对人体副作用的认识, 现在大部分镍钛合金表面改性都在以减少镍离子析出为基本出发点来提高材料耐蚀性和生物相容性。 但在化学改性过程中, 可能会出现有毒物质的污染及制备的表面易失效的问题, 因此开展无毒无污染的化学改性研究以提高植入体的使用性与稳定性, 对增强植入体的安全性具有重要的意义。
(3)面对镍钛合金表面单一改性制备的微纳结构不稳定、 耐蚀性及生物相容性不满足使用要求等问题, 探索多技术复合改性, 取长补短的发展道路是很有价值的。如将可构建规则微结构的微铣削技术与可制备纳米孔阵列管的阳极氧化技术结合起来, 依次对镍钛合金进行改性处理, 制备出有序的微/ 纳结构, 为改善植入体的生物相容性提供了新的思路。
参考文献 References
[1] QI Y, QI H, HE Y, et al. ACS Applied Materials & Interfaces[J], 2018, 10(1): 182-192.
[2] 张源, 郑瑞宁, 刘芸, 等. 稀有金属材料与工程[J], 2023, 52(1): 374-387.
ZHANG Y, ZHENG R N, LIU Y, et al. Rare Metal Materials and En- gineering[J], 2023, 52(1): 374-387.
[3] ANDANI M T, SAEDI S, TURABI A S, et al. Journal of the Mechan- ical Behavior of Biomedical Materials[J], 2017, 68: 224-231.
[4] AMMAR O, HADDAR N, DIENG L. Intermetallics[J], 2017, 81: 52-61.
[5] KHALILI V, NAJI H. Surface and Coatings Technology[J], 2020, 397: 125985.
[6] FU X, LIU X, HAO D, et al. Frontiers in Bioengineering and Bio- technology[J], 2021, 9: 516.
[7] HAMANN I, GEBHARDT F, EISENHUT M, et al. Materials[J], 2021, 14(11): 3098.
[8] KHORASANI A M, GOIDBERG M, DOEVEN E H, et al. Journal of Biomaterials & Tissue Engineering[J], 2015, 5(8): 593-619.
[9] MENG L, LI Y, PAN K, et al. Materials Letters[J], 2018, 230: 228-231.
[10] 刘明, 李军, 张延晓, 等. 稀有金属材料与工程[J], 2021, 50(11): 4165-4173. LIU M, LI J, ZHANG Y X, et al. Rare Metal Materials and Engineer- ing[J], 2021, 50(11): 4165-4173.
[11] RUPÉREZ E, MANERO J M, BRAVO-GONZÁLEZ L A, et al. Mate- rials[J], 2016, 9(6): 402.
[12] MWANGI J W, NGUYEN L T, BUI V D, et al. Journal of Manufac- turing Processes[J], 2019, 38(2): 355-369.
[13] NARGATTI K, AHANKARI S. Journal of Intelligent Material Systems and Structures[J], 2022, 33(4): 503-531.
[14] ZHANG K, LIU F, TAN C, et al. Materials Science and Engineering: A[J], 2022, 848: 143426.
[15] 杨大智, 吴明雄. Ni-Ti 形状记忆合金在生物医学领域的应用[M]. 北京: 冶金工业出版社, 2003: 61-63.
YANG D Z, WU M X. Application of Ni-Ti Shape Memory Alloy in Biomedical Field[M]. Beijing: Metallurgical Industry Press, 2003: 61-63.
[16] 夏振翔. 镍钛合金表面三氧化二铝微弧氧化膜的制备及性能研究 [D]. 哈尔滨: 哈尔滨工业大学, 2016.
XIA Z X. Preparation and Research on Properties of AI2O3 Coatings on NiTi Alloy Surface by Mic-Roarc Oxidation[D]. Harbin: Harbin Institute of Technology, 2016.
[17] 金胡日查, 沈吴钦, 许家婧, 等. 稀有金属[J], 2022, 46(9): 1190-1198.
JIN H R C, SHEN W Q, XU J J, et al. Chinese Journal of Rare Met- als[J], 2022, 46(9): 1190-1198.
[18] KAPOOR, DEEPAK. Johnson Matthey Technology Review[J], 2017, 61(1): 66-76.
[19] 朱姿虹. NiTi 合金表面无镍层及生物改性层制备与表征[D]. 镇 江: 江苏大学, 2016.
ZHU Z H. Preparation and Characterization of Ni-Free Layer and Bio- modified Layers on the Suface of NiTi Alloy[D]. Zhenjiang: Jiangsu University, 2016.
[20] LAI T Y, LIN K P, LIANG S W, et al. Materials Research Express [J], 2019, 6(4): 045036.
[21] JANI J M, LEARY M, SUBIC A, et al. Materials & Design[J], 2014, 56: 1078-1113.
[22] KURTO LU S F, YA CI M B, UZUN A, et al. Applied Surface Sci- ence[J], 2020, 525: 146547.
[23] MANJAIAH M, NARENDRANATH S, BASAVARAJAPPA S. Trans- actions of Nonferrous Metals Society of China[J], 2014, 24(1): 12- 21.
[24] GUO Y, KLINK A, FU C, et al. CIRP Annals-Manufacturing Tech- nology[J], 2013, 62(1): 83-86.
[25] ZENG X, DU Z, SCHUH C A, et al. MRS Communications[J], 2017, 7(4): 747-754.
[26] MWANGI J W, ZEIDLER H, KUHN R, et al. Suitability Assessment of Micro-EDM in Machining Nitinol for Medical Applications[C] / / Eu-Spen's 16th International Conference & Exhibition. Cambridge: Cambridge University Press, 2016.
[27] DORNELAS V M, OLIVEIRA S A, SAVI M. International Journal of Mechanical Sciences[J], 2020, 170: 105345.
[28] CHEN X, CHEN W, MA Y, et al. Mechanics of Materials[J], 2020, 145: 103402.
[29] DUERIG T W, BHATTACHARYA K. Shape Memory and Superelas- ticity[J], 2015, 1(2): 153-161.
[30] ROBERTSON S W, PELTON A R, RITCHIER O. International Mate- rials Reviews[J], 2012, 57(1): 1-37.
[31] CHEN X, LIU K, GUO W, et al. Rapid Prototyping Journal[J], 2019, 25(8): 1421-1432.
[32] WITKOWSKA J, SOWIN′ SKA A, CZARNO-WSKA E, et al. Applied Surface Science[J], 2017, 421: 89-96.
[33] CHLANDA A, WITKOWSKA J, MORGIEL J, et al. Micron[J], 2018, 114: 14-22.
[34] 李启荣, 李文博, 牛楚涵, 等. 钛工业进展[J], 2021, 38(5): 41- 48.
LI Q R, LI W B, NIU C H, et al. Titanium Industry Progress[J], 2021, 38(5): 41-48.
[35] ZHU Y, LIU D, WANG X, et al. Journal of Materials Chemistry B [J], 2019, 7(12): 2019-2031.
[36] 林钟石, 黄虹蓉, 臧德跃, 等. 中国医疗设备[J], 2020, 35(4): 27-32.
LIN Z S, HUANG H R, ZANG D Y, et al. China Medical Devices [J], 2020, 35(4): 27-32.
[37] LIU Y, REN Z, BAI L, et al. Corrosion Science[J], 2017, 123: 209-216.
[38] JIANG J Y, XU J L, LIU Z H, et al. Applied Surface Science[J], 2015, 347: 591-595.
[39] YUN Y, LAI Y, ZHANG Q, et al. Colloids & Surfaces B: Biointer- faces[J], 2010, 79(1): 309-313.
[40] CHEN J, XU J L, HUANG J, et al. Journal of Materials Science[J], 2021, 56(12): 7698-7709.
[41] BRASH J L, HORBETT T A, LATOUR R A, et al. Acta Biomateria- lia[J], 2019, 94: 11-24.
[42] YODA I, KOSEKI H, TOMITA M, et al. BMC Microbiology[J], 2014, 14(1): 1-7.
[43] WANG G, WANG S, YANG X, et al. Surface and Coatings Technolo- gy[J], 2020, 405: 126512.
[44] 麻西群, 于振涛, 牛金龙, 等. 有色金属材料与工程[J], 2018, 39 (6): 26-31.
MA X Q, YU Z T, NIU J L, et al. Nonferrous Metal Materials and Engineering[J], 2018, 39(6): 26-31.
[45] PORTELLA Q, CHEMKHI M, RETRAINT D. Materials Character- ization[J], 2020, 167: 110463. [46] ES-SOUNI M, WASSEL E, DIETZE M, et al. Materials & Design [J], 2019, 182: 108031.
[47] NGUYEN T T, HU C C, CHOU B Y, et al. Journal of Materials Re- search and Technology[J], 2022, 18: 1115-1123. [48] DUDEK K, GORYCZKA T. Ceramics International [J], 2016, 42 (16): 19124-19132.
[49] KUO W C, WU T C, WU C F, et al. Materials Today Communications [J], 2021, 27: 102306.
[50] ZHAO Y, WANG Z, BAI L, et al. Materials Science and Engineer- ing: C[J], 2021, 123: 112007.
[51] GOLSHIRAZI A, GOLAFSHAN N, KHARAZIHA M. Materials Today Communications[J], 2022, 32: 104085.
[52] XU J L, LAI T, LUO J M. Progress in Organic Coatings[J], 2019, 137: 105271.
[53] SHI Z, ZHANG X. Materials & Design[J], 2017, 131: 323-333.
[54] TOHIDI P, SAFAVI M S, ETMNANFAR M, et al. Materials Chemis- try and Physics[J], 2020, 254: 123511.
[55] MAITY K P, CHOUBEY M. Surface Review and Letters[J], 2019, 26 (5): 1830008.
[56] FENG C C, LI L, ZHANG C S, et al. Materials [J], 2019, 12 (3): 388.
[57] ZAINAL A Z, TARISAI M P, HARRISON G. International Journal of Precision Engineering and Manufacturing-Green Technology[J], 2020, 7(2): 283-297.
[58] KUPPUSWAMY R, YUI A. The International Journal of Advanced Manufacturing Technology[J], 2017, 93(1): 11-21.
[59] LI W, WANG Z, WANG D, et al. Optical Engineering[J], 2014, 53 (3): 034109.
[60] HSIEH S F, LIN M H, CHEN S L, et al. The International Journal of Advanced Manufacturing Technology[J], 2016, 86(5): 1475-1485.
[61] 冯超超, 李丽, 赵玉刚, 等. 中国表面工程[J], 2019, 32(2): 8.
FENG C C, LI L, ZHAO Y G, et al. China Surface Engineering[J], 2019, 32(2): 8.
[62] 赵林, 李丽, 王好臣, 等. 表面技术[J], 2017, 46(2): 138-143.
ZHAO L, LI L, WANG H C, et al. Surface Technology[J], 2017, 46 (2): 138-143.
[63] 刘云, 李丽, 李瑶, 等. 表面技术[J], 2017, 46(9): 252-257. LIU Y, LI L, LI Y, et al. Surface Technology[J], 2017, 46(9): 252-257. [64] DING W, CAO Z, WANG B, et al. Advances in Materials Science and Engineering[J], 2019, 2019(1): 3706750.
[65] WANG T, WAN Y, LIU Z. Advanced Engineering Materials[J], 2016, 18(7): 1259-1266.
[66] ZHANG D, WANG L, QIAN H, et al. Journal of Coatings Technology and Research[J], 2016, 13(1): 11-29.
[67] BARTLET K, MOVAFAGHI S, DASI L P, et al. Colloids and Sur- faces B: Biointerfaces[J], 2018, 166: 179-186.
[68] ZHANG X, WAN Y, LIU Z, et al. Procedia CIRP[J], 2020, 89: 222-227.
[69] HOU Y, XU J, LIAN Z, et al. Fabrication of super-hydrophobic NiTi shape memory alloy surface with inclined microstructure by wire elec- trical discharge machining[C] / / 2021 IEEE International Conference on Manipulation, Manufacturing and Measurement on the Nanoscale (3M-NANO). Atlanta: IEEE, 2021: 324-327.
[70] TIAN Y L, ZHAO Y C, YANG C J, et al. Journal of Colloid and In- terface Science[J], 2018, 527: 328-338.
[71] HUANG C, YE X, YANG X, et al. Surface Engineering[J], 2020, 36(6): 558-564.
[72] 岳端木, 孙会来, 刘泽林, 等. 激光与红外[J], 2021, 51(4): 6.
YUE D M, SUN H L, LIU Z L, et al. Laser and Infrared[J], 2021, 51(4): 6.
[73] ZHOU R, LU X, LIN S, et al. Journal of Laser Micro/ Nanoengineer- ing[J], 2017, 12(1): 22-27.
[74] PU Z, JING X, YANG C, et al. International Journal of Applied Ce- ramic Technology[J], 2020, 17(5): 2182-2192.
[75] XIANG S, YUAN Y, ZHANG C, et al. ACS Omega[J], 2022, 7(7): 5954-5961.
[76] CUI Z, LI S, ZHOU J, et al. Surface and Coatings Technology[J], 2020, 391: 125730.
[77] ZHANG R, MANKOCI S, WALTERS N, et al. Journal of Biomedical Materials Research Part B: Applied Biomaterials[J], 2019, 107(6): 1854-1863. [78] HANG R, LIU Y, LIU S, et al. Corrosion Science[J], 2016, 103 (2): 173-180.
[79] WU Y, ZHAO W, WANG W, et al. RSC Advances[J], 2016, 6(6): 5100-5110.
[80] YANG Z, WEI X, GAO W, et al. Surface and Coatings Technology [J], 2014, 252: 142-147.
[81] OHTSU N, HIRANO Y, YAMAGUCHI K, et al. Applied Surface Sci- ence[J], 2019, 492: 785-791.
[82] OHTSU N, YAMASAKI K, TANIHO H, et al. Surface and Coatings Technology[J], 2021, 412: 127039.
[83] CHEN M A, HUANG L A, SHEN X A, et al. Acta Biomaterialia[J], 2020, 105: 304-318.
[84] DING Y, YUAN Z, LIU P, et al. Materials Science and Engineering: C[J], 2020, 111: 110851.
[85] 唐萍, 江少群, 王刚. 中国材料进展[J], 2021, 40(8): 631-638. TANG P, JIANG S Q, WANG G. Materials China[J], 2021, 40(8): 631-638. [86] YING Y, YANG W, YAN H, et al. Materials Letters[J], 2014, 120 (1): 155-158.
[87] MILOŠEV I, METIKOŠ-HUKOVIC′ M, PETR-OVIC′ Ž. Materials Sci- ence and Engineering: C[J], 2012, 32(8): 2604-2616.
[88] ZHAO Y, SUN Y, LAN W, et al. Journal of Materials Science and Technology[J], 2021, 78: 110-120.
[89] WITKOWSKA J, RUDNICKI J, PIEKOSZEW-SKI W, et al. Vacuum [J], 2018, 156: 135-139.
[90] WITKOWSKA J, TARNOWSKI M, CHOIN′ SKA E, et al. Materials [J], 2021, 14(17): 4842.
[91] SHARMA S K, MOHAN S. Journal of Alloys & Compounds [J], 2014, 592(14): 170-175.
[92] HUANG J, WAN G J, SU X, et al. Journal of Nanomaterials[J], 2012, 2012(1): 731592.
[93] YANG C J, ZHAO Y C, TIAN Y L, et al. Colloids and Surfaces A: Physicochemical and Engineering Aspects[J], 2019, 567: 16-26.
[94] WAN Y, XU L, LIU Z, et al. Micro & Nano Letters[J], 2017, 12 (3): 175-178.
[95] LI J, XU J, LIAN Z, et al. Optics & Laser Technology[J], 2020, 126: 106129.
[96] YANG Z, TIAN Y, ZHAO Y, et al. Materials [ J ], 2019, 12 (2): 278.
[97] WANG M, ZHANG D, YANG Z, et al. Langmuir[J], 2020, 36(34): 10279-10292.
[98] CHMIELEWSKA A, DOBKOWSKA A, KIJE-N ′ SKA-GAWRON ′ E, et al. International Journal of Molecular Sciences [ J ], 2021, 22 (24): 13209.
[99] GAO X, GUO Z. Journal of Colloid & Interface Science[J], 2018, 512: 239-248.
[100] YANG C, CAO W, YANG Z, et al. Journalof Bionic Engineering [J], 2021, 18(1): 77-91.
[101] NGUYEN H T, BUI H M, WANG Y F, et al. Sustainable Chemistry and Pharmacy[J], 2022, 28: 100714.
[102] TANG Y, CAI Y, WANG L, et al. Optics & Laser Technology[J], 2022, 153: 108190.
[103] WANG W, LI J, LI R, et al. ACS Applied Materials & Interfaces [J], 2019, 11(37): 34507-34516.
[104] WANG M, YANG Z, YANG C, et al. Applied Surface Science[J], 2020, 527: 146889.



yongyiti.com
永益钛手机网